Protein & Cell | 生物岛实验室合作揭示新冠病毒感染导致急性呼吸窘迫症的细胞机理
来源: 本网 作者: 本网 日期: 2020-07-16
7月16日,生物岛实验室与中科院广州生物医药与健康研究院、广州市第八人民医院合作在Protein & Cell杂志以“Single-cell analysis reveals bronchoalveolar epithelial dysfunction in COVID-19 patients” 为题发表了新冠病人(COVID-19)急性呼吸窘迫症致病机理的研究。
新冠病毒严重威胁人类生命健康安全,截止目前已造成全球1300多万人被感染,超过57万人死亡。肺是新冠病毒感染的主要器官,目前大部分新冠病人的直接死因是缘由呼吸衰竭导致的急性呼吸窘迫症(ARDS)。ARDS是新冠危重症患者的主要病症,同时病程极长,导致重症监护室(ICU)资源急剧耗尽。因此,新冠危重症的ARDS病理机制研究对于有效应对疫情具有重要意义。
肺主要由数以百万计的肺泡组成,肺泡是基本的呼吸单元,其表面附着有非常多的毛细血管,机体通过毛细血管和肺泡膜完成气体交换,不同肺泡之间通过支气管互相连接,最后连接气管再到口/鼻,这就是完整的呼吸管道。临床检测及尸检结果表明1,重症新冠病人病毒感染后会刺激肺产生大量凝胶状流动性极差的粘液,这些粘液会堵塞支气管甚至肺泡,使正常呼吸气体交换受阻,是造成重症患者ARDS的重要原因之一。正常生理情况下,这些粘液分泌对人体是有利的,它们能够吸附我们吸入的空气中的灰尘、病原体等有害物质,同时在纤毛细胞的帮助下(通过纤毛摆动)将粘液清理排出体外(即痰液)。但在病理情况下,粘液分泌过多就对人体有害,比如前面说的堵塞气管,影响正常呼吸。并且会促进炎症,加剧病毒感染及机体损伤。目前,新冠病人肺部粘液从何而来并不清楚,因此,了解新冠病人肺部粘液产生的来源及原因将对临床治疗具有重要的指导意义。
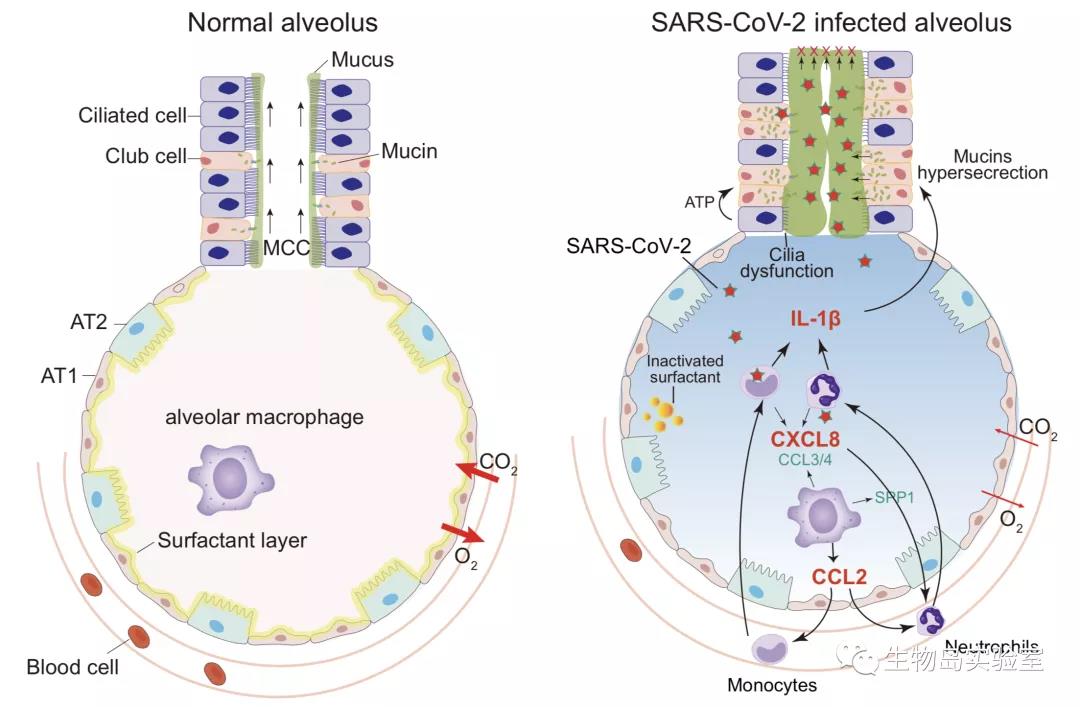
基于上述关键问题,研究团队通过收集新冠病人肺泡灌洗液进行单细胞转录组测序(scRNA-seq),发现黏蛋白家族相关基因MUC5AC和MUC5B等在病人中显著高表达,且主要富集于一种称为Club的上皮细胞,提示新冠病人粘液主要来源于肺Club细胞。研究同时发现病毒感染后,纤毛生成及细胞结构相关基因如FOXJ1、RFX3、IFT27、DNAI2等表达显著下降,同时,ATP合酶基因表达显著升高,表明ATP含量会升高。之前的研究表明,ATP刺激能够导致粘液分泌上调数千倍。上述结果表明新冠病毒感染后Club细胞粘液过度分泌,同时纤毛活性下降,进一步使得分泌过多的粘液无法正常排出体外,加剧这些粘液在肺部过度堆积,直至最后堵塞了肺内部的支气管,引起呼吸衰竭。机理上,研究团队发现,病毒感染后,肺泡巨噬细胞会分泌细胞因子CCL2招募单核/中心粒细胞到受感染的区域从而被激活,这些被激活的单核/中心粒细胞会进一步分泌促炎因子IL-1β以及其他细胞因子如CXCL8、CCL3/4等,IL-1β会进一步刺激Club细胞导致粘液过度分泌,指示IL-1β可能是新冠治疗比较合适的药物靶点之一。值得关注的是,在本研究审稿期间,发表于国际医学期刊Lancet Rheumatol上一项回顾性研究发现,针对COVID-19病人使用IL-1β拮抗剂治疗,72%的病人病情得到明显好转2。
生物岛实验室细胞命运与谱系研究中心(CCLA)/中科院广州生物医药与健康研究院陈捷凯研究员,广州市第八人民医院重症医学科邓西龙主任,中科院广州生物医药与健康研究院陈新文研究员为本研究的共同通讯作者。生物岛实验室细胞命运与谱系中心(CCLA)何江平副研究员、蔡宝美,广州市第八人民医院蔡水江,中国科学院广州生物医药与健康研究院研究生冯辉坚、林立惠为共同第一作者。同时,本研究得益于广州医科大学呼吸疾病国家重点实验室赵金存研究员的大力合作和钟南山院士的指导。 值得一提的是,从2020年1月27日开始,为有效应对新型冠状病毒(SARS-CoV2)感染肺炎疫情防控工作,增加对突发疾病的防治能力,生物岛实验室就开始组织召开了新型冠状病毒紧急攻关项目。本项研究是生物岛实验室新型冠状病毒紧急攻关项目的重要成果,对新冠疫情的致病机理与防控或具有重要启示意义。 参考文献 1 Liu, Q. et al. Gross examination report of a COVID-19 death autopsy. Fa Yi Xue Za Zhi 36, 21-23, doi:10.12116/j.issn.1004-5619.2020.01.005 (2020). 2 Cavalli, G. et al. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. Lancet Rheumatol 2, e325-e331, doi:10.1016/s2665-9913(20)30127-2 (2020).