Molecular Cell|科研团队揭示体细胞重编程的细胞命运决定路径
来源: 本网 作者: 本网 日期: 2019-02-13
细胞是生物基本的结构和功能单位。复杂的多细胞生物在发育过程中通过细胞特化产生了多种不同的细胞命运,探究这些细胞命运产生的原因,进而实现细胞命运的高效转变,是亟待解决的重要科学问题。研究细胞命运转变的关键之一是选择动态的细胞变化过程,比如干细胞的分化(Differentiation)、体细胞的转分化(Trans-differentiation)或者体细胞重编程(Reprogramming)等。2006年日本科学家Shinya Yamanaka发明的诱导多能干细胞(induced pluripotent stem cell, iPSC)技术【1】被广泛的应用于细胞命运转变的研究。尽管iPSC技术建立之后的十几年内,科学家针对重编程过程的分子机制进行了诸多研究并揭示了一些规律,但针对效率低、异质性极高的iPSC重编程过程还鲜见对其精确细胞命运变化路径及调控机制的报道。
2019年2月14日,中国科学院广州生物医药与健康研究院(广州再生医学与健康广东省实验室依托单位)陈捷凯研究组和裴端卿研究组合作在Molecular Cell在线发表题为Resolving Cell Fate Decisions during Somatic Cell Reprogramming by Single-Cell RNA-seq的研究论文,利用单细胞RNA-seq技术,揭示了小鼠体细胞重编程过程中细胞命运的动态变化过程。文章利用新开发的Single-cell Orientation Tracing (SOT)算法,解读单细胞测序数据,发现由重编程之一的转录因子KLF4产生的非重编程分支,以及细胞因子IFN- γ带来的多能性建立障碍,提出了广泛适用于细胞命运决定的分支模型(bifurcation model)。这一发现有助于我们理解体细胞重编程经历的分子路径,并且提供了利用单细胞测序分析复杂命运变化的研究中“发现分支——预测原因——功能验证”的研究范式。

这项研究用OCT4/SOX2/KLF4(OSK)三个转录因子感染小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF),之后用课题组前期开发的化合物成分确定的高效iPSC诱导培养基进行诱导,重编程效率可以达到10%【2】,这就保证了尤其在最早的时间点依然可以采集到大量未来可以形成iPSC的细胞。接下来,课题组通过囊胚注射实验确定重编程第七天时已经获得了能够产生嵌合体小鼠的完全重编程iPSC。因此,课题研究人员用Fluidigm C1平台收取了重编程第0、1、2、3、5、7、8天,以及MEF、胚胎干细胞(mouse embryonic stem cell, mESC)、iPS细胞系样品进行单细胞转录组测序,结果显示OSK重编程早期细胞呈现出较为一致的变化,包括去分化、间质-上皮转化等过程,但是从重编程第2天开始,细胞异质性变得难以区分,不同天数的细胞进入到混合的状态。
如何利用单细胞测序数据,在茫茫两万多个基因中,寻找真正与细胞命运关系最大的基因变化,并且将体细胞重编程的路径清晰的展示出来呢?研究人员在尝试了一些主流的分析方法但无法获得理想结果之后,研究人员开发了Single-cell Orientation Tracing (SOT)新算法。这一算法假设重要的生物学功能由多个共表达的基因共同行使,数据降维应指向功能并排除不同功能使用的基因数目的影响。SOT使用吸引子模型计算高度相关的基因簇,并计算出基因簇的特征表达模式,再进一步通过diffusion map学习细胞转变的路径结构,最终在二维平面上展示出相应的细胞变化路径。最终,使用SOT(R package请点击https://github.com/JiekaiLab/SOT)在原来混合的D2-8的细胞中寻找到了两个新的分支,根据其基因表达模式预测一条为重编程分支,而另一条是非重编程(non-reprogramming, NR)分支。
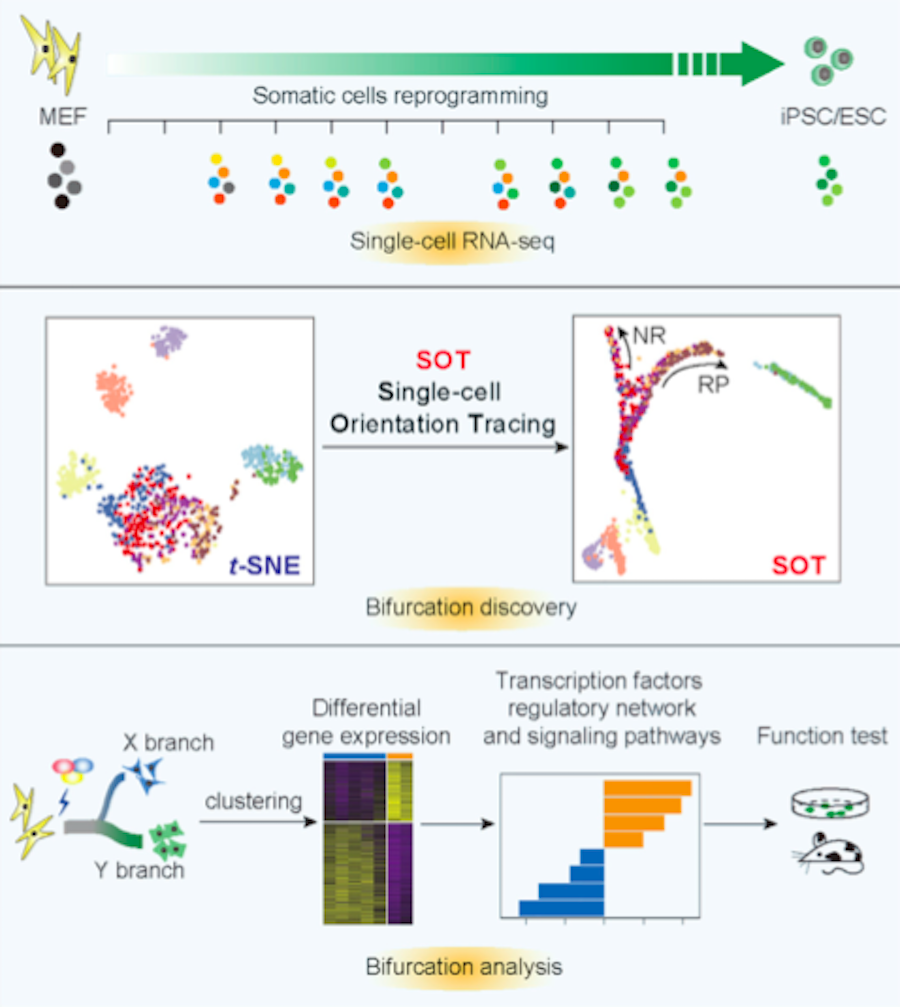
那么,通过SOT获得细胞命运分支是否真实可信呢?研究人员比较了分支的表达谱,发现非重编程分支细胞具有较高的角质细胞特征,而其中CD34可以作为非重编程分支细胞分选的标志物,经过细胞分选后的继续重编程实验验证,CD34+的非重编程细胞分支细胞基本丧失了重编程能力,并可维持特异的细胞形态及CD34表达。
接下来为了探究造成这一非重编程分支的原因,研究人员开展了对不同分支差异基因上游调控转录因子以及信号通路的分析研究。令人惊奇的是,这一研究发现用于重编程的转录因子KLF4是造成非重编程分支的重要原因。课题组在前期的研究中阐明KLF4是推动重编程早期间质-上皮转化(mesenchymal-to-epithelial transition, MET)事件的重要重编程因子【3、4】,这说明重编程因子在重编程过程中起到了双刃剑的作用。无独有偶,在本研究后面部分用10x genomics对59,141个OSK重编程细胞进行路径分析,在SOT绘制的路径中除了重编程分支、角质细胞样非重编程分支外,还发现了一个类似神经样细胞的新非重编程分支,而SOX2可能是造成这个分支的重要原因。
iPSC作为多能干细胞,其最主要的功能是参与胚胎发育,前面提到重编程第七天开始产生具有产生嵌合体能力的iPSC,据此研究人员对最终多能性的产生步骤进行分析,发现该过程是一个新的重编程限速步骤。研究发现了Dppa5a作为重编程完成步骤的标志基因,通过囊胚注射实验证明Dppa5a阳性细胞可以准确标记重编程晚期出现的少量具有嵌合能力的iPSC。进一步通过比较这群细胞和重编程分支其他细胞的基因表达,发现了重编程过程中有少量细胞能够分泌细胞因子IFN- γ,这一天然免疫通路的激活抑制了细胞重编程的完成步骤。
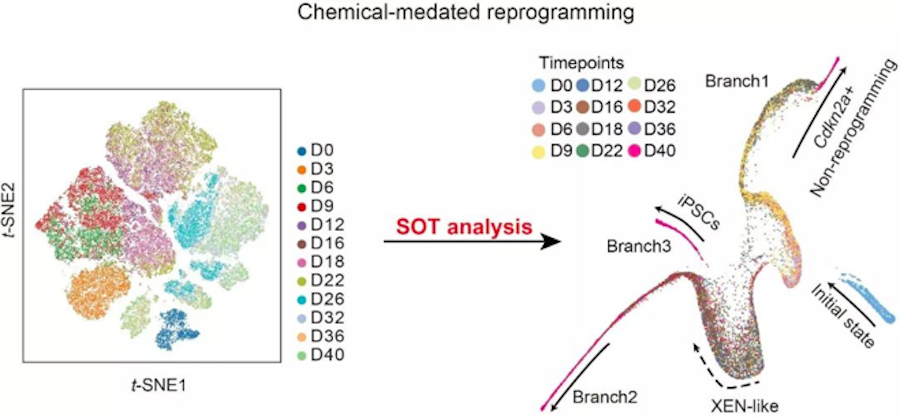
最后,对比OSK重编程系统,研究人员对化合物诱导体细胞重编程体系【5】(Cell Stem Cell丨化学诱导iPS的最新方法以及重编程过程中染色质动态变化过程)进行单细胞测序分析,发现利用SOT算法同样能够将混合在一起的不同时间点的细胞样品,清晰的绘制出重编程路线以及非重编程分支。这提示我们,尽管体细胞在不同的重编程方法下,经历的分子路径以及产生的非重编程分支不同,但都遵循细胞命运变化过程中的分支现象,通过单细胞测序的方法发现细胞命运分支的产生,找到影响分支产生的原因,能够更好的实现对生理或病理条件下细胞命运变化理解,实现控制细胞命运变化的目标。
中国科学院广州生物医药与健康研究院的陈捷凯研究员和裴端卿研究员为本文的共同通讯作者,郭琳博士,博士研究生林立惠和王晓山博士为共同第一作者。